Zusammenfassung
CC
Jüngste Studien von Kevin McKernan, einem führenden Experten für Sequenzierungsmethoden für DNA und RNA ergaben, dass Chargen der modifizierten mRNA-Produkte von Pfizer und Moderna einen hohen Anteil an kontaminierung in Form von bakterieller DNA enthalten.
Schenk uns bitte ein Like auf Facebook! #meinungsfreiheit #pressefreiheit
Danke!
Insgesamt macht die DNA bis zu 20-35 % der Nukleinsäuren in den einzelnen Chargen aus.
Bei mehreren Chargen übersteigen die Konzentrationen um ein Tausendfaches die Werte, die von normgebenden Organisationen wie der Europäischen Arzneimittelagentur (EMA) als unbedenklich bzw zulässig gelten.
Hier werden zuerst die Beweise für diese DNA-Kontamination zusammengefasst und erörtert. Demnach werden die bekannten Gesundheitsrisiken dieser Nebenprodukte beschrieben.
Trotz aller Bemühungen, die hier vorgeführte Materie überschaubar zu gestalten, sollte der Leser bereits über die Grundlagen der neuen mRNA-Produkte als Basiswissen verfügen.
1 Die Rolle der DNA bei der Herstellung von mRNA-Produkte
1.1 Allgemeiner Hintergrund. Allgemein bekannt ist, dass:
1. die in den COVID-19-mRNA-Produkte enthaltenen synthetischen RNAs für das SARS- CoV-2 Spike-Protein kodieren;
2. die Anweisungen für den Bau eines bestimmten Proteinmoleküls in menschlichen Zellen als Gen in der DNA im Zellkern gespeichert sind;
3. um ein bestimmtes Eiweißmolekül zu bauen, die Zelle zunächst das Gen in RNA umschreibt und daraufhin die beiden Enden dieses Moleküls ändert, um Boten-RNA (mRNA) zu bilden.
4. die mRNA dann aus dem Zellkern in das Zytoplasma transportiert wird, wo sie die Proteinfabriken der Zelle (Ribosomen) dazu veranlasst, die Nukleotidsequenz der mRNA in die entsprechende Aminosäuresequenz zu übersetzen und das Protein zusammenzubauen.
1.2 Schritte bei der Herstellung von mRNA-Produkten.
Da das Spike-Protein ein großes Molekül ist, ist auch die mRNA, die es kodiert, entsprechend lang. Die chemische Totalsynthese großer mRNA-Moleküle ist in großem Maßstab nicht praktikabel. Aus diesem Grund wird das mRNA-Molekül, das für Spike kodiert, durch Bakterien derart hergestellt:
1. Eine DNA-Kopie des Gens für das Spike-Protein wird in ein bakterielles Plasmid umwandelt.
Ein Plasmid ist ein ringförmiges, doppelsträngiges DNA-Molekül, das durch Bakterienzellen aufgenommen werden kann, und unabhängig von deren zelleigenen chromosomalen DNA auch kopiert und an Tochterzellen weitergegeben werden kann, wenn sich die Zelle teilt.
2. Das rekombinante (künstliche) Plasmid, wird in eine Zelle der Bakterienart Escherichia coli (E. coli) eingeführt.
Da sich E. coli Zellen sich sehr schnell teilen, kann diese eine Zelle innerhalb kurzer Zeit zu einer eine sehr große Anzahl von Zellen wachsen. Jede dieser Nachkommenschaftszellen enthält ihre eigenen ererbte Kopien des Plasmids und damit des Spike-Protein-Gens.
Es besteht hierbei eine gewisse Wahrscheinlichkeit, dass das Plasmid bei aufeinander folgenden Zellteilungen bei einigen der Nachkommen nicht mehr aufzufinden ist. Deswegen werden die die Bakterien, die Plasmid enthalten, durch eine künstliche selektion beforzugt. Bei den Plasmiden von Pfizer und Moderna wird ein Gen, das die Wirtszellen mit einer Resistenz gegen das Antibiotikum Kanamycin verleiht, zu dem Spike-Plasmid hinzugefügt. Die Bakterien werden daraufhin in Gegenwart von Kanamycin gezüchtet; solche die dem gewünschten Plasmid aufgenonmmen haben und ihr Plasmid-Programm zur Resistenz ausführen überleben und vermehren sich besser als diejenigen ohne die Plasmid-verleihte resistenz.
3. Nachdem eine ausreichende Anzahl von Bakterienzellen in einer Kanamycin-haltigen Nährbrühe gezüchtet wurde, werden diese Zellen aufgebrochen und die Plasmid-DNA von den anderen bakteriellen Zellbestandteilen getrennt.
4. Die ringförmigen Plasmidmoleküle werden mit Hilfe eines Restriktionsenzyms in eine lineare Form umgewandelt, das beide Stränge des DNA-Moleküls an einer spezifischen, einzigartigen Stelle spaltet. Die lineare Form ist notwendig um die gewünschte gen-Sequenz in mRNA (bnw modRNA) form zu umwandeln.
[Die linearisierten DNA-Moleküle müssen von den verbleibenden zirkulären Plasmiden gereinigt werden, aber auf welche Weise und wie effizient dies bei der Herstellung der Gentechnik-Produkte von Pfizer und Moderna geschehen kann, ist nicht öffentlich bekannt. Die 'geleakte' Emails der EMA Behörde weisen darauf hin das sie darüber ernsthafte Bedenken aüßerten, und auch von den Herstellern Klärung forderten -- leider ohne Erfolg. Das ist ein kritischer Punkt in der Geschichte, also bitte nochmal lesen.]
5. Eine RNA-Polymerase wird in Gegenwart der erforderlichen Nukleosidbausteine und Cofaktoren verwendet, um das Spike-Protein-Gen von der DNA-Version auf dem linearisierten Plasmid in die mRNA-Version zu kopieren. Sowohl Pfizer als auch Moderna verwenden die T7-RNA-Polymerase.
In diesem Stadium wird das synthetische Nukleosid N-Methyl-Pseudouridin (mψU) anstelle des natürlichen Nukleosids Uridin in die künstliche RNA substituiert, um das sog. "modRNA" zu erzeugen. Wenn sie in Form eines sog. "Impfstoffs" verabreicht wird, wird die auf diese Weise modifizierte RNA weniger anfällig fur Angriffe durch das angeborene Immunsystem als eine RNA, die das natürliche Uridin enthält. Außerdem wird modRNA effizienter in Proteine übersetzt und ist unter bestimmten Bedingungen widerstandsfähiger gegen den Abbau [1].
6. Die beiden Enden jedes RNA-Moleküls werden enzymatisch an bestimmte Bestandteile gekoppelt, die auch in natürlichen mRNAs von Säugetieren an diesen Stellen zu finden sind und die ihre biologische Aktivität und Stabilität in vivo erhöhen.
Auf diese Weise entsteht eine funktionsfähige mRNA, die in der Lage ist, die Ribosomen der Zellen anzuweisen, das Spike-Protein zu produzieren. In diesem Stadium ist das Produkt jedoch noch nicht rein - die bakteriell gewonnene Template-DNA ist noch vorhanden. Letztere sollte nicht in das endgültige Arzneimittel aufgenommen werden, da sie ein Gesundheitsrisiko für die Empfänger darstellt (siehe Abschnitt 4). Um diese DNA loszuwerden, wird ein weiteres Enzym namens DNase hinzugefügt. Dieses soll die DNA in kleinere Fragmente aufspalten, die dann durch Filtration und andere Reinigungstechniken von den viel größeren RNA-Molekülen getrennt werden können. Im letzten Schritt wird die mRNA mit einer Lipidmischung kombiniert, um sie in jene Lipid-Nanopartikel (LNPs) zu verpacken, die menschliche Zellen dazu veranlassen, das mRNA-Molekül aufzunehmen und das Spike-Protein herzustellen.
2 Was wussten wir bisher über das Problem der DNA-Kontamination?
Kurz gesagt, sehr wenig. In den Bewertungsberichten der FDA zu beiden "Impfstoffen" [2, 3] wird das Problem mit keinem Wort erwähnt. Im Bewertungsbericht der Europäischen Arzneimittel-Agentur (EMA) über den "Impfstoff" von Pfizer heißt es: "Die Robustheit des DNase-Verdauungsschritts wird nicht als umfassend nachgewiesen angesehen" [4, S. 17]. Eine ähnliche Formulierung wird in dem EMA-Bericht über den Moderna-Produkt verwendet [5, S. 19f].
3 Unabhängige Beweise für die DNA-Kontamination von mRNA-Produkten
Mit Stand vom 3. April 2023 hat Kevin McKernan seine jüngsten Erkenntnisse in drei Artikeln auf seiner Substack-Seite beschrieben [6-8]. Die in den ersten beiden Berichten beschriebenen Experimente wurden an Proben von neu eingeführten "bivalenten Impfstoffen" von Pfizer und Moderna durchgeführt. Diese Präparate ähneln in ihrer chemischen Zusammensetzung den bisherigen "monovalenten", d. h. sie sollten hochreine mRNA enthalten, die mit einer Mischung aus Lipidmolekülen (fettähnlich) zu mRNA/Lipid-Nanopartikeln komplexiert ist. Der einzige Unterschied zwischen den beiden Varianten besteht darin, dass die bivalenten "Impfstoffe" eine Mischung aus zwei mRNAs enthalten, die für verschiedene antigene Varianten des Spike-Proteins kodieren. Dies hat keine Auswirkung auf das technische Problem der DNA-Kontamination als solches. Wir stellen jedoch fest, dass das Ausmaß der DNA-Kontamination zwischen den Produktionschargen variieren kann und dass bisher nur eine kleine Anzahl von Chargen in dieser Hinsicht getestet und analysiert wurde.
3.1 Der erste Bericht von McKernan.
In einer ersten Studie [6] charakterisierte McKernan sowohl die RNA als auch die in den mRNA-Produkte enthaltene DNA.
3.1.1 Extraktion und direkte Charakterisierung der Nukleinsäuren aus den Gen-Spritzen.
Der erste Schritt bestand darin, die Lipide abzulösen, um die reinen Nukleinsäuren zu erhalten. Die von ihm verwendete lösungsmittelbasierte Methode unterscheidet nicht zwischen DNA und RNA - wenn beide vorhanden sind, werden auch beide gewonnen. Die extrahierten Nukleinsäuren wurden nach ihrer Größe getrennt.
Dabei wurden nicht nur die erwarteten regulären Spike-mRNA-Arten in voller Länge gefunden, sondern auch kleinere Fragmente, die zuvor sowohl von den Regulierungsbehörden als auch in einer von einem der Hersteller veröffentlichten Arbeit festgestellt worden waren [9]. Überraschenderweise wurden auch RNA-Spezies gefunden, die größer sind als die mRNA in voller Länge. Diese Spezies bleiben uncharakterisiert.
3.1.2 Amplifikation der extrahierten Nukleinsäuren.
Als vorbereitender Schritt für die Bestimmung der genauen Nukleotidsequenzen der extrahierten Nukleinsäuren wurden diese durch PCR-Methoden amplifiziert. Im Falle der RNA ging der PCR eine reverse Transkription in DNA unter Verwendung eines speziellen Enzyms (reverse Transkriptase) voraus. Da in dieser Studie in erster Linie die RNA und nicht die DNA untersucht werden sollte, wurde dieser Vervielfältigungsschritt selektiv für RNA durch Zugabe von Actinomycin D ausgeführt (welches unter den gegebenen Versuchsbedingungen die DNA-Synthese selektiv hemmt). Dementsprechend blieben relativ geringe Mengen an DNA in der amplifizierten Probe übrig. Im Falle des Pfizer-Produktes überstieg trotz dem die ermittelte DNA-Menge den von der EMA (willkürlich) festgelegten Grenzwert für den maximal zulässigen Anteil an DNA pro RNA. (Auch das sollte man zweimal lesen...)
3.1.3 Ergebnisse der DNA-Sequenzierung.
Sowohl für die Produkte von Pfizer als auch für die von Moderna wurden DNA-Sequenzen von vollständigen DNA-Plasmiden erhalten, wobei im Falle der Moderna-Plasmide gewisse Unklarheiten bestehen. Die Merkmale der Plasmidsequenzen werden daher im Zusammenhang mit der zweiten Studie von McKernan erörtert, bei der mehr und reinere DNA für die Sequenzierung verwendet wurde und die daher zuverlässigere Ergebnisse lieferte.
3.2 Der zweite Bericht von McKernan.
Die zweite Studie [7] konzentrierte sich auf die Quantifizierung und Charakterisierung der DNA-Kontamination, die in der ersten Studie qualitativ festgestellt worden war.
3.2.1 Die in den mRNA-Produkten enthaltene Plasmid-DNA ist in der Lage, sich in Bakterienzellen zu vermehren.
Im ersten Versuch wurde festgestellt, ob die Plasmid-DNA, deren Vorhandensein aus den vorangegangenen Sequenzierungsergebnissen abgeleitet wurde, tatsächlich biologisch funktionsfähig ist, d. h. ob sie in Bakterienzellen eingeführt werden und dort verbleiben kann. Zu diesem Zweck wurden erneut Nukleinsäuren aus den Proben extrahiert. Diese Nukleinsäuren wurden mit einer Suspension von E. coli-Zellen gemischt, die für die DNA-Aufnahme kompetent gemacht worden waren.
Nachdem diese Zellen zur Aufnahme der DNA veranlasst worden waren und einige Zeit zur Erholung hatten, wurden sie auf Petrischalen ausgebreitet, die mit verfestigtem, Kanamycin enthaltendem Wachstumsmedium gefüllt waren. Wie bereits erwähnt, tötet Kanamycin alle E. coli-Zellen ab, die kein Resistenzgen dagegen enthalten. Daher bestätigte das beobachtete Wachstum von Bakterienkolonien auf diesen Petrischalen, dass einige Zellen tatsächlich eine Resistenz gegen Kanamycin erworben hatten, indem sie die Plasmide aufnahmen und vermehrten. Dies wurde sowohl bei den proben von Pfizer als auch von Moderna beobachtet.
In diesem Zusammenhang ist anzumerken, dass nur zirkuläre Plasmidmoleküle, nicht aber linearisierte, effizient in Bakterienzellen eingebracht werden können. Der Erfolg dieses Experiments deutet daher darauf hin, dass einige der Plasmidmoleküle den Linearisierungsschritt (Schritt 4 in Abschnitt 1.2) nicht durchlaufen haben und den gesamten Produktionsprozess in der zirkulären Form, die in Bakterienzellen existiert, überstanden haben. Da die Zahl der in diesem Experiment beobachteten Bakterienkolonien jedoch nicht hoch war, ist es wahrscheinlich, dass der größte Teil der DNA tatsächlich linearisiert wurde. Da die biologischen Gefahren von Fremd-DNA in unserem eigenen Körper je nachdem, ob es sich um lineare oder zirkuläre DNA handelt, unterschiedlich sein können, ist das wahrscheinliche Vorhandensein beider Formen in den mRNA-Produkten erwähnenswert. Die genauen Anteile von zirkulärer und linearer DNA in den Mischungen müssen noch ermittelt werden.
3.2.2 Die Häufigkeit von kontaminierender DNA.
Das zweite wichtige Ergebnis dieser Studie ist die Quantifizierung der in den proben enthaltenen DNA und mRNA mittels PCR. Wie Sie vielleicht wissen, wird bei einer PCR-Reaktion ein ausgewählter Abschnitt einer Nukleinsäuresequenz durch enzymatische Synthese in mehreren aufeinanderfolgenden Reaktionszyklen vervielfältigt. Aus der Anzahl der Zyklen (oder Verdopplungen), die erforderlich sind, um eine bestimmte Schwellenkonzentration zu erreichen, lässt sich berechnen, wie viele Kopien der Zielsequenz zu Beginn vorhanden waren.
In diesen Experimenten wurde als Versuchsformat die Multiplex-PCR gewählt, d. h. zwei Zielsequenzen wurden in einer einzigen Reaktionsmischung amplifiziert. Eine dieser Zielsequenzen befand sich innerhalb des Spike-Protein-Gens und sollte daher sowohl auf den Plasmid-DNA-Molekülen als auch auf den von ihnen transkribierten Spike-mRNA-Molekülen vorhanden sein. Um die mRNA-Moleküle in diese Amplifikation einzubeziehen, wurde der PCR wiederum eine reverse Transkription vorgeschaltet.
Die andere Zielsequenz befand sich innerhalb des Kanamycin-Resistenzgens, das nur auf der Plasmid-DNA vorhanden sein sollte. Durch den Vergleich der Anzahl der Zyklen, die für jedes der beiden Ziele erforderlich sind, um den Schwellenwert zu überschreiten, wurde festgestellt, dass bis zu 35 % der gesamten in den mRNA-Produkten enthaltenen Nukleinsäure tatsächlich DNA ist. Zum Vergleich: Die EMA hat festgelegt, dass der Anteil der DNA an den gesamten Nukleinsäuren nicht mehr als 0,033 % betragen darf.
3.2.3 Bestimmung der Plasmid-DNA-Sequenzen.
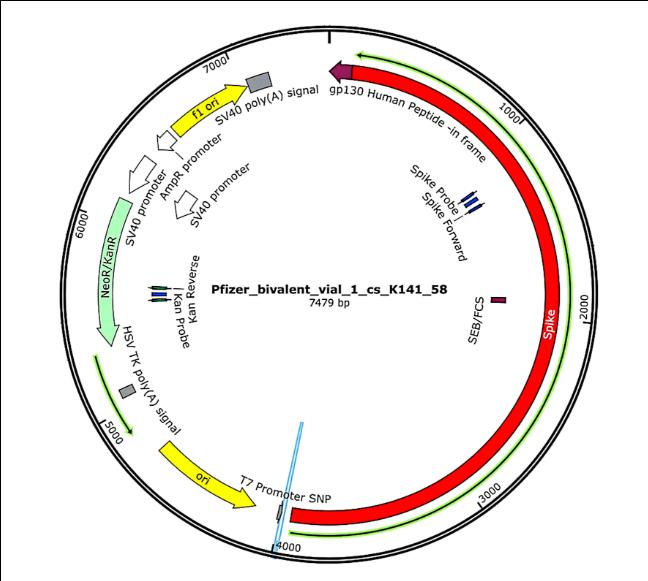
Die Plasmide, die ursprünglich in den "Impfstoffen" enthalten waren und dann in Bakterienzellen eingebracht wurden (siehe Abschnitt 3.2.1), wurden erneut aus diesen Bakterienkulturen isoliert, und ihre vollständigen DNA-Sequenzen wurden bestimmt. Diese Sequenzen wurden in der ersten Studie von McKernan [6] vollständig angegeben, aber er gab an, dass er noch an der Bestätigung und Verfeinerung der Sequenzierungsdaten arbeitet. Die funktionellen Merkmale der in den proben von Pfizer gefundenen Plasmid-DNA sind in Abbildung 1 dargestellt. Sie werden im Zusammenhang mit der Risikobewertung erörtert.
CC-By-SA 4.0 Kevin McKernan
Abbildung 1 Karte der Plasmid-DNA, die in einem der bivalenten mRNA-fläschchen von Pfizer enthalten ist.
Die funktionellen Merkmale sind aus der experimentell bestimmten DNA-Sequenz abgeleitet. Das für das Spike-Protein kodierende Gen (rot), dessen Transkription durch den T7-Promotor angetrieben wird, macht etwa die Hälfte der gesamten DNA-Sequenz aus. Das "NeoR/KanR"-Gen (hellgrün) kodiert ein Protein, das Bakterienzellen resistent gegen Kanamycin oder Neomycin bzw. menschliche Zellen resistent gegen das verwandte Antibiotikum G418 macht. Die gelbe Sequenz mit der Bezeichnung "ori" ist der bakterielle Replikationsursprung; sie bewirkt, dass Kopien des Plasmids in der Bakterienzelle entstehen. Die von SV40 abgeleiteten Elemente oben links können die Expression der G418-Resistenz in menschlichen Zellen induzieren und enthalten auch einen Replikationsursprung, der die Vermehrung des Plasmids in menschlichen Zellen verursachen kann. Sie fehlen in den Plasmiden von Moderna, die ansonsten den Plasmiden von Pfizer ähnlich sind. Siehe Text für weitere Einzelheiten. Die Abbildung wurde aus [7] übernommen.
3.3 Der dritte Bericht von McKernan.
In seinem bisher letzten Bericht untersuchte McKernan acht Fläschchen einer früheren Charge des Pfizer-Produktes mit der oben beschriebenen quantitativen PCR-Methode. Der DNA-Gehalt war in diesem Fall deutlich niedriger als bei den bivalenten proben, lag aber immer noch um das 18-70fache über dem EMA-Grenzwert [8].
4 Risikobewertung
Es ist davon auszugehen, dass die in den mRNA-Produkten enthaltene rekombinante DNA in die Zellen unseres Körpers eingeschleust werden kann und dass dies, wie bei der mRNA selbst, durch die Lipid-Nanopartikel begünstigt wird. Dies birgt verschiedene Gesundheitsrisiken.
4.1 Längere Dauer der Expression von Spike-Proteinen.
Ein Hauptargument, das regelmäßig angeführt wird, um den Eindruck zu erwecken, dass mRNA-Produkte sicher sind, ist, dass mRNA in vivo kurzlebig ist und dass die Expression des kodierten Antigens daher ebenfalls von kurzer Dauer sein wird. So heißt es beispielsweise im EMA-Bewertungsbericht über den "Impfstoff" von Pfizer in Bezug auf Tierversuche mit einem Modellimpfstoff, die anstelle geeigneter Studien mit dem eigentlichen COVID-19-Produkt akzeptiert wurden [4, S. 46]:
"Wie bei einem mRNA-Produkt zu erwarten, war die Luciferase-Expression vorübergehend . . . Das Signal nahm während der ersten 72 Stunden langsam ab und nach 6 und 9 Tagen waren die Signale weiter abgeschwächt und betrugen etwa das 18- bzw. 7-fache mal so hoch wie die Signale von Tieren, denen eine Pufferkontrolle injiziert wurde."
Diese Ergebnisse scheinen mit zwei In-vitro-Studien übereinzustimmen, in denen die Dauer der Proteinexpression zwischen Boten-RNA-Spezies verglichen wurde, die in ihrer Sequenz identisch waren, aber Uridin bzw. mψU enthielten; wie oben erwähnt, ist letzteres auch in den mRNA-Produkte von Pfizer und Moderna enthalten. In beiden Studien [1, 10] induzierten die mψU-modifizierten RNA-Spezies eine signifikant höhere Proteinexpression, dennoch nahm diese erhöhte Expression mit einer ähnlichen Halbwertszeit ab wie die der unmodifizierten RNA. Keine der Halbwertszeiten, die sich aus den Daten der beiden Studien ableiten lassen, überschreitet 4,5 Tage.
Aus mehreren Studien an "geimpften" Personen geht jedoch hervor, dass sowohl das Spike-Protein selbst als auch die dafür kodierenden Nukleinsäuren noch Wochen und sogar Monate nach der Injektion im Blutkreislauf und in verschiedenen Organen nachgewiesen werden können [11-15]. Diese Diskrepanz zwischen In-vitro- und In-vivo-Studien war bisher schwer zu verstehen. Die von McKernan festgestellten hohen Mengen an Restplasmid-DNA in den mRNA-Produkten lassen nun eine plausible Erklärung zu.
Damit die bakterielle Plasmid-DNA eine verlängerte Expression des Spike-Proteins unterstützen kann, müssen zwei Bedingungen erfüllt sein:
1. Die Plasmid-DNA muss in unseren Körperzellen (oder auch in unserer Darmflora) verbleiben, und
2. das Spike-Protein-Gen auf diesem Plasmid muss von unserer eigenen zellulären RNA-Polymerase in mRNA umgeschrieben werden.
Zwar liegen uns noch keine direkten experimentellen Daten zu den Spike-Expressionsplasmiden von Pfizer und Moderna vor, doch deuten Präzedenzfälle darauf hin, dass diese beiden Anforderungen erfüllt sind. Es wurde festgestellt, dass rekombinante Plasmide, die den Gerinnungsfaktor IX exprimieren, in den Leberzellen von Versuchstieren bis zu 1,5 Jahre lang in stabilen Konzentrationen verbleiben [16, 17], was der gesamten Dauer des Versuchs entspricht. Man könnte einwenden, dass die in diesen Studien verwendeten Plasmide zirkulär waren, während der größte Teil der Plasmid-DNA, die in den mRNA-Produkten enthalten ist, wahrscheinlich in linearer Form vorliegt (siehe Abschnitt 1.2). Dem ist zu entgegnen, dass erstens wahrscheinlich ein Teil der zirkulären Plasmid-DNA verbleibt (siehe Abschnitt 3.2.1) und zweitens, dass rekombinante virale DNA nachweislich dass rekombinante virale DNA in linearer Form über ebenso lange Zeiträume in Tieren verbleiben kann [18], was darauf hindeutet, dass dies auch bei Plasmid-DNA der Fall sein kann.
In den zitierten Studien [16, 17] stand das Gen, das für das wesentliche Protein (Faktor IX) kodiert, unter der Kontrolle eines Säugetierpromotors, und das Faktor-IX-Protein wurde tatsächlich durchgehend in stabilen Mengen exprimiert. Im Gegensatz dazu steht das Spike-Protein-Gen in den Expressionsplasmiden von Pfizer und Moderna unter der Kontrolle eines T7-Bakteriophagen-Promotors. Wir können nicht a priori davon ausgehen, dass dieser Promotor in Abwesenheit seiner 'cognate' T7-RNA-Polymerase funktioniert. Es wurde jedoch experimentell bestätigt, dass der T7-Promotor auch die zelluläre RNA-Polymerase II bindet und die Proteinexpression in Säugetierzellen bewirkt [19].
Darüber hinaus deutet das Vorhandensein von E. coli in der menschlichen Darmflora auf einen möglichen Weg hin, auf dem die Personen, die die Gentransfektionsprodukte erhalten, das Spike-Protein auf unbestimmte Zeit in ihrem Körper exprimieren können.
Zusammenfassend lässt sich sagen, dass die Möglichkeit, dass die beobachtete lang anhaltende Expression von Spike-Protein durch die in den mRNA-Produkten enthaltene Plasmid-DNA verursacht wird, ernst genommen werden muss. Die verlängerte Persistenz von Spike-Protein-mRNA und ihre Expression nach der "Impfung", die in Biopsien und Autopsien nachgewiesen wurde, wurde eindeutig mit schwerwiegenden Schäden verbunden [14, 20], die höchstwahrscheinlich durch Immunangriffe auf die Zellen, die dieses fremde Antigen exprimieren.
Das Ausbleiben der entsprechenden experimentellen Studien in der Phase der präklinischen Versuche in Verbindung mit dem Ausmaß dieser Kontamination stellt ein völlig inakzeptables Sicherheitsrisiko dar.
4.2 Risiken im Zusammenhang mit von SV40 abgeleiteten regulatorischen DNA-Sequenzen.
Ein Merkmal, das McKernan auf den Expressionsplasmiden von Pfizer, nicht aber auf denen von Moderna identifiziert hat [6], ist ein vom SV40-Virus abgeleiteter Promotor, der zur Polyoma-Familie gehört (siehe Abschnitt 4.2). Dieser Promotor befindet sich stromaufwärts des Kanamycin-Resistenzgens; und da er in Säugetierzellen aktiv ist, wird das von diesem Resistenzgen kodierte Protein in jeder Zelle, die diese DNA enthält, exprimiert. Wie das Spike-Protein ist auch dieses Protein ein fremdes Antigen und kann daher ebenfalls einen Immunangriff auf die Zellen auslösen, die es exprimieren.
Der SV40-Promotor enthält auch einen internen Replikationsursprung, der dazu führen kann, dass Kopien des Plasmids in Säugetierzellen gebildet werden [21]. Voraussetzung dafür ist das Vorhandensein des viralen großen T-Antigens, eines Proteins, das diesen Ursprung direkt erkennt und dann die Replikation des DNA-Moleküls einleitet. Dieses Protein wird weder vom Plasmid kodiert, noch ist es normalerweise in unseren Körperzellen vorhanden, aber es könnte entweder vom SV40-Virus selbst oder von einem verwandten Polyoma Virus stammen. Ein teil der menschlichen Bevölkerung ist latent mit SV40 infiziert, und diese latente Infektion wird mit einigen bösartigen und nicht bösartigen Tumoren in Verbindung gebracht [22].
Sollte eine Kopie des Pfizer-Plasmids in eine Zelle aufgenommen werden, die SV40 beherbergt, dann könnten in der Tat zusätzliche Kopien davon gebildet werden.
Zwei verwandte Polyoma-Viren, die in der menschlichen Bevölkerung viel weiter verbreitet sind, sind das BK- und das JC-Virus [23, 24]. Das JC large T-Antigen ist in Verbindung mit dem SV40-Ursprung offenbar weniger wirksam als das SV40-eigene Protein [25],
Dennoch kann die Replikation des Plasmids von Pfizer in Zellen, die latent mit JC- oder BK-Viren infiziert sind, nicht ausgeschlossen werden. Zusätzliche Kopien des auf diese Weise erzeugten Plasmids würden alle anderen in diesem Abschnitt diskutierten Risiken verstärken, mit der mit der möglichen Ausnahme einer unspezifischen Entzündung (siehe Abschnitt 4.4).
4.3 Genomische Insertion der Plasmid-DNA.
Die bisher diskutierten Szenarien beschreiben die unabhängige episomale Persistenz der Plasmid-DNA; sie wird in der Nähe der Chromosomen (innerhalb des Zellkerns) präsent, aber sie wird nicht zu einem integraler Bestandteil eines der Chromosomen. Solche unabhängigen, nicht-replizierenden Plasmidmoleküle neigen dazu, während der Zellteilung verloren zu gehen [26]. Wie wir noch sehen werden, kann ein Plasmidmolekül jedoch in einigen Fällen tatsächlich in eines der Chromosomen seiner Wirtszelle integriert werden, und es wird dann an alle Nachkommen dieser Zelle vererbt. Die chromosomale Integration ist eine Form der "Genotoxizität", d. h. der Toxizität, die genetische Schäden verursacht. In Bezug auf die Möglichkeit solcher Wirkungen stellt der EMA-Bewertungsbericht über den mRNA-Produkt von Pfizer lapidar fest [4, S. 50]:
"Es wurden keine Studien zur Genotoxizität vorgelegt. Dies ist akzeptabel, da es sich bei den Bestandteilen der Produktformulierung um Lipide und RNA handelt, bei denen kein genotoxisches Potenzial zu erwarten ist."
Offenbar gingen die Experten der EMA davon aus, dass RNA im Allgemeinen die Integrität des Wirtszellgenoms nicht beeinträchtigt. Diese Ansicht ist falsch, und der erste Beweis hat kürzlich sein fünfzigjähriges Jubiläum gefeiert [27]. Allerdings mit dem Nachweis großer Mengen von Plasmid-DNA in den mRNA-Produkte beider Hersteller erübrigt sich diese Argumentation. Sicherlich sind sich auch die Wissenschaftler der EMA bewusst dass diese DNA in das Genom der menschlichen Wirtszellen integriert werden kann. Keine spezifischen Sequenzmerkmale sind für eine solche Integration erforderlich, und dementsprechend ist sie DNA von Säugetierviren, Bakteriophagen und Plasmiden beobachtet worden Plasmiden beobachtet [28]. Es ist erwähnenswert, dass solche Einfügungen an zufälligen Stellen des Genoms auftreten können des Genoms auftreten können, aber Gene, die von der Zelle aktiv exprimiert werden, sind häufiger betroffen [29].
Die stabile chromosomale Integration eines bakteriellen Plasmids in die chromosomale DNA von Säugetierzellen wurde bereits 1982 nachgewiesen [30]. Das betreffende Plasmid weist zahlreiche Gemeinsamkeiten mit den Plasmiden auf, die bei der Herstellung der mRNA-Produkte von Moderna und Pfizer verwendet werden. Das Einschleusen von fremden oder veränderten Genen in Säugetierzellen mit Hilfe dieser und ähnlicher Techniken ist in der experimentellen Forschung und in der Biotechnologie inzwischen gang und gäbe. Die Methodik wird als Transfektion bezeichnet, und die auf diese Weise veränderten Organismen als transgene. Wir stellen fest dass eine stabile Integration sowohl mit linearer als auch mit zirkulärer Plasmid-DNA erfolgen kann [31].
In diesem Zusammenhang ist auch die zuvor veröffentlichte Studie von Aldén et al. [32] zu berücksichtigen, die DNA-Kopien des Spike-Protein-Gens in einer menschlichen Leberzelllinie nachwiesen, nachdem diese Zellen dem mRNA-Produkt von Pfizer ausgesetzt worden waren. Ausgehend von der Annahme, dass der "Impfstoff" im Wesentlichen reine mRNA, aber keine DNA enthielt, werteten sie diese Beobachtung als Beweis dafür, dass die synthetische mRNA in diesen Zellen eine reverse-Transkription in diesen Zellen durchlaufen hat. Ihre Interpretation ist plausibel, denn eine solche reverse Transkription ist prinzipiell bekannt und wurde bereits früher in Zellen von Patienten, die mit dem SARS-CoV-2-Virus infiziert waren, berichtet [33].
In Anbetracht der Entdeckung von McKernan, dass die fläschchen von Pfizer erhebliche Mengen an DNA enthalten können, scheint es jedoch ebenso möglich, dass die Beobachtungen von Aldén et al. lediglich auf die zelluläre Aufnahme dieser DNA hinweisen. In jedem Fall deuten ihre Ergebnisse auf das Vorhandensein von Spike-kodierender DNA in diesen Zellen hin, was ein Risiko der genomischen Insertion bedeutet.
4.3.1 Genomische Einfügung bei der Gentherapie mit retroviralen Vektoren.
Bei der eigentlichen Gentherapie ist die chromosomale Integration häufig erwünscht, da sie den betreffenden Gendefekt dauerhaft korrigiert. Zu diesem Zweck sind spezielle DNA-Vektoren entwickelt worden, die eine stark erhöhte Neigung zu einer solchen Integration haben.
Diese Vektoren sind von Retroviren abgeleitet, deren gesamte Überlebensstrategie auf der genomischen Integration beruht. Es hat sich jedoch herausgestellt, dass die Integration, wenn sie an der falschen Stelle im Genom stattfindet, häufig bösartige Krankheiten, insbesondere Leukämie, auslöst [34]. Diese Tatsache ist so häufig, dass sie die breite Anwendung der Gentherapie verhindert hat, selbst bei Krankheiten, bei denen alle anderen therapeutischen Optionen ebenfalls mit sehr großen Risiken behaftet sind. Ein gutes Beispiel dafür ist der Adenosin-Deaminase-Mangel, eine Stoffwechselkrankheit, die die Lymphozyten auslöscht und so eine schwere kombinierte Immunschwäche (SCID) verursacht, die ohne Behandlung im Säuglingsalter immer tödlich ist. Diese Krankheit ist im Prinzip ein sehr geeignetes Ziel für eine Gentherapie, aber eine Knochenmarktransplantation von einem passenden und verwandten Spender aufgrund des hohen Risikos gentherapeutisch induzierter Tumoren die bevorzugte Therapieoption [35].
4.3.2 Wie verursacht die genomische Insertion Krebserkrankungen?
Unser Genom enthält eine Vielzahl von Genen, die Krebs auslösen können, wenn ihr Expressionsniveau - die Rate, mit der mRNA und Proteinmoleküle aus ihnen synthetisiert werden - entweder zu niedrig oder zu hoch ist. Ein fremdes DNA-Molekül kann sich direkt in ein solches Gen einfügen und es ausschalten, oder es kann sich daneben einfügen, und ein starker Promotor auf dieser fremden DNA kann eine übermäßige Expression des fraglichen Gens verursachen. Darüber hinaus wurde beobachtet, dass Insertionsereignisse auch genomweite Veränderungen in der DNA-Methylierung verursachen können, die sich auf die Expressionswerte vieler Gene auswirken; einige dieser Veränderungen können zur Entstehung von Tumoren beitragen. Wichtig ist, dass dieser Effekt nicht nur bei viraler DNA, sondern auch bei bakteriellen Plasmiden beobachtet wurde [36].
Wenn Zellen aus einem gesunden menschlichen oder tierischen Organ isoliert und in einer Zellkultur gezüchtet werden, teilen sie sich für eine begrenzte Anzahl von Generationen und sterben dann ab. Im Gegensatz dazu können Zellen aus bösartigen Tumoren und Leukämien unbegrenzt vermehrt werden. Eine ähnliche Veränderung kann auch bei kultivierten Zellen eintreten, die dadurch unsterblich werden und typischerweise auch einige Merkmale verlieren, die für ihr Ursprungsgewebe charakteristisch sind. Diese Transformation kann durch die Infektion der Zellen mit dem bereits erwähnten SV40-Virus ausgelöst werden. In ähnlicher Weise können die Zellen transformiert werden durch Transfektion mit einem von SV40 abgeleiteten Plasmid transformiert werden, das die entscheidenden Teile des viralen Genoms, einschließlich des Gens, das für das große T-Antigen kodiert, beibehält. Fehlt hingegen das große T-Antigen auf dem Plasmid, kommt es in der Regel nicht zur Transformation [30]. Es wurden jedoch auch einige Ausnahmen berichtet [37, 38]. Diese Fälle müssen durch die Störung oder Dysregulation von zellulären Genen entstanden sein, die an der Kontrolle der Vermehrung beteiligt sind.
4.3.3 Genomische Integration in Keimbahnzellen.
Eizellen können in bestimmten Reifestadien in vivo transfiziert werden [39], ebenso wie spermienproduzierende Zellen in den Hoden [40]. In letzterem Fall erwiesen sich die Nachkommen der so behandelten Tiere als transgen. Es ist daher nicht auszuschließen, dass Personen, die mit mRNA-Produkten "geimpft" werden, die auch DNA enthalten, später transgene Kinder zur Welt bringen.
Das Einbringen von DNA in Keimbahnzellen könnte auch die frühe intrauterine Entwicklung stören und dadurch Fehlgeburten oder Missbildungen hervorrufen.
4.3.4 Wie ist das Risiko einer Integration der mRNA-Produkte ins Menschliche Genom zu bewerten?
Es ist sicherlich richtig, dass bakterielle Plasmide eine geringere Neigung haben, sich in unsere chromosomale DNA einzufügen als Gentherapievektoren, die speziell für eine effiziente Integration entwickelt wurden. Doch wie groß ist das Risiko im Falle der in den mRNA-Vakzinen enthaltenen Plasmide genau?
Die einfache Antwort lautet: Niemand weiß es. Das liegt nicht daran, dass man es prinzipiell nicht weiß, sondern daran, dass die entsprechenden experimentellen Studien an Tieren und später am Menschen nicht durchgeführt wurden; oder wenn doch, wurden die Ergebnisse der Öffentlichkeit und offenbar auch den Regulierungsbehörden vorenthalten.
Wie würden solche Risiken in einem ordnungsgemäß durchgeführten Zulassungsverfahren bewertet werden?
In den aktuellen FDA-Leitlinien für die Prüfung und Zulassung von Gentherapien [41] wird empfohlen, die Patienten in der Phase der klinischen Prüfung 15 Jahre lang nach der Verabreichung zu überwachen, wobei in den ersten fünf Jahren jährliche Untersuchungen durchgeführt werden sollten. Dies gilt für Vektoren, mit denen eine chromosomale Insertion beabsichtigt ist. In dem Leitfaden wird weiterhin eine irreführende Dichotomie zwischen insertierenden und nicht-insertierenden Vektoren konstruiert, da die Trennlinie zwischen ihnen unscharf bleibt. Einerseits suggeriert der Leitfaden, dass:
"GT [Gentherapie]-Produkte, die auf Vektoren wie Plasmiden basieren, ... nicht dazu neigen, sich zu integrieren oder nach einer Latenzzeit zu reaktivieren, im Allgemeinen ein geringeres Risiko für verzögerte unerwünschte Ereignisse aufweisen,"
andererseits heißt es aber auch,
"dass Änderungen bei den Methoden zur Einführung von Plasmid-DNA-Vektoren in Zellen . . . zu einer höheren Integrationshäufigkeit führen (Ref. 27)."
Bei der im letztgenannten Zitat angeführten Referenz handelt es sich um eine Studie von Wang et al. [42], die nach intramuskulärer Injektion und anschließender Elektroporation eindeutig eine DNA-Insertion von Plasmid-DNA in vivo nachweisen konnten. Die Elektroporation erhöhte zwar die zelluläre Aufnahme der injizierten DNA im Vergleich zur Injektion von "nackter" DNA allein, war aber in dieser Hinsicht wahrscheinlich viel weniger wirksam als die in den mRNA-Produkten enthaltenen Lipid-Nanopartikel. Dementsprechend müssen wir eine gewisse chromosomale Integration der kontaminierenden Plasmid-DNA in vivo erwarten.
4.4 Entzündungsfördernde Wirkung der bakteriellen DNA.
Das angeborene Immunsystem des Menschen reagiert mit Entzündungen auf verschiedene bakterielle Makromoleküle, darunter auch DNA. Es muss davon ausgegangen werden, dass die in den mRNA-Produkten enthaltenen großen Mengen an DNA zu Entzündungen in der Nähe der Injektionsstelle und möglicherweise auch an anderen Stellen im Körper beitragen.
5 Schlussfolgerung
Das Vorhandensein von kontaminierender Plasmid-DNA in den mRNA-Produkten von Pfizer und Moderna birgt schwerwiegende Gesundheitsrisiken, die zu den bereits bekannten und verstandenen Risiken hinzukommen. Zu diesen Risiken gehören vor allem die verlängerte Expression des Spike-Proteins, die zu einer entsprechend verlängerten und zerstörerischeren autoimmunähnlichen Entzündung führen kann, sowie die Induktion bösartiger Erkrankungen nach chromosomalen Integration der Plasmid-DNA. Darüber hinaus beweist das schiere Ausmaß der Kontamination eindeutig, dass die Hersteller die vorgesehenen Produktionsprozesse nicht beherrschen oder nicht ordnungsgemäß umgesetzt haben.
Jeder dieser Punkte allein wäre Grund genug, die sofortige Rücknahme dieser Impfstoffe zu fordern.
Zitaten und Quelltext: https://drtrozzi.org/wp-content/uploads/2023/04/COVID-19-mRNA-vaccines-contain-excessive-DNA-Evidence-and-Implications.pdf
Übersetzung und aufarbeitung von Clort (mit Unterstützung von deepl.com)
Revision 2.3, 25 April 2023
